Дезинфекция насосного оборудования: методы, реагенты, системы дозирования и контроль качества воды

Дезинфекция — это совокупность мер, направленных на уничтожение возбудителей инфекционных заболеваний в окружающей среде. В промышленных и технологических процессах, где насосное оборудование взаимодействует с жидкостями, подверженными микробиологическому загрязнению, дезинфекция служит важным условием соблюдения санитарно-гигиенических норм. Особенно это актуально в пищевой, фармацевтической, коммунальной и химической отраслях
Зачем нужна дезинфекция в насосных системах
В зависимости от области применения и степени риска распространения инфекции используются различные методы и средства дезинфекции — от простых растворов на основе хлора до современных высокотехнологичных установок. Эффективная дезинфекция требует не только правильно подобранных средств, но и соблюдения технологических регламентов, что особенно актуально в условиях повышенных эпидемиологических требований

В зависимости от задач и этапов эксплуатации оборудования различают несколько видов дезинфекции
- профилактическая — проводится планово для предотвращения загрязнений
- текущая — осуществляется в процессе работы оборудования при обнаружении признаков загрязнения
- заключительная — применяется после завершения производственного цикла или перед консервацией насосной системы
Каждый из этих видов может реализовываться с помощью различных методик, которые подбираются с учётом материала конструкции, типа загрязнений и технологических требований. В числе наиболее распространённых методов:
- механическая очистка (удаление налёта, остатков среды)
- физическое воздействие (горячая вода, пар, УФ-обработка)
- химическая дезинфекция (щелочные, кислотные, дезинфицирующие растворы)
- биологические средства (редко, но применяются в специфических установках)
- комбинированные подходы, сочетающие несколько технологий для повышения эффективности
Регулярная и грамотно организованная дезинфекция насосного оборудования снижает риск микробного заражения, предотвращает порчу продукции и способствует бесперебойной работе всего технологического процесса
Область применения дезинфекции насосного оборудования
Дезинфекционные мероприятия необходимы в различных сферах, где насосы играют важную роль в перекачивании жидкостей. Обработка оборудования обеспечивает санитарную безопасность, предотвращает развитие биоплёнок и способствует поддержанию стабильного качества технологических процессов

Водоснабжение
Удаление микробиологических загрязнений в насосных станциях, обеспечивающих подачу питьевой и технической воды

Плавательные бассейны
Предотвращение размножения патогенной микрофлоры в насосах, циркулирующих воду в системах фильтрации и рециркуляции

Пищевая промышленность
Санитарная обработка насосов, перекачивающих напитки, молоко, концентраты, сиропы и другие продукты с высоким риском микробного заражения

Градинные установки (градирни)
Профилактика бактериального загрязнения (включая легионеллы) в насосах, участвующих в системе охлаждения промышленных объектов
Фармацевтика и косметическая отрасль
Обеспечение стерильности оборудования при работе с растворами, гелями и активными веществами

Коммунальные и очистные сооружения
Предотвращение распространения болезнетворных микроорганизмов в насосах, задействованных в системах ливневой, сточной и канализационной воды
Широкая применимость дезинфекции делает её неотъемлемой частью эксплуатации насосного оборудования, особенно в условиях, где чистота и микробиологическая безопасность критически важны
Основные дезинфектанты и их свойства
В промышленной дезинфекции, особенно в пищевом производстве, применяются различные химические вещества, отличающиеся механизмом действия, физико-химическими свойствами и областью допустимого применения
Диоксид серы (сернистый ангидрид) — SO₂
Бесцветный удушающий газ или жидкость с высокой плотностью (2,927 г/л). Температура плавления: –75,5°C, кипения: –10,01°C. Эффективен против широкого спектра микроорганизмовПерекись водорода (пергидроль) — H₂O₂
Бесцветная жидкость с плотностью 1,452 г/см³. Температура плавления: –0,43°C, кипения: 152°C. Обладает мощными окислительными свойствами, разлагается с выделением кислорода и тепла, что усиливает её дезинфицирующий эффектПеруксусная кислота (надуксусная) — CH₃COOOH
Бесцветная жидкость с резким запахом, плотность 1,226 г/см³. Температура плавления: 0,1°C, кипения: 105°C. Обладает высокой активностью и биоразлагаемостью, но крайне взрывоопаснаОзон — O₃
Мощный окислитель, используемый для дезинфекции всех видов воды и поверхностей. Образуется на месте, требует точных систем дозирования. Не оставляет остаточных продуктов и не требует смывания
Эти вещества используются индивидуально или в сочетании в зависимости от требований безопасности, типа оборудования и технологической среды. Выбор дезинфектанта требует строгого учёта условий эксплуатации, что особенно важно для насосных установок, работающих с химически активными или температурно нестабильными жидкостями
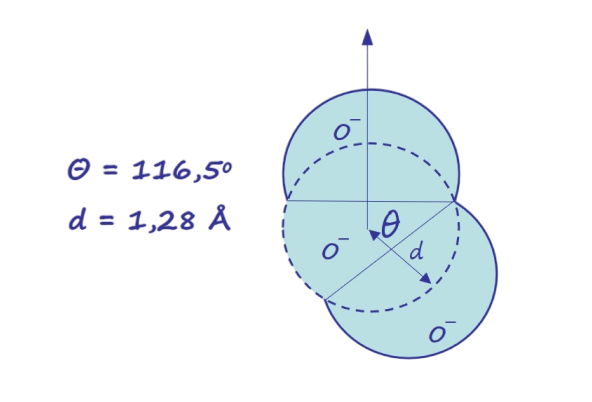
Схематическое изображение молекулы воды (H₂O)
- θ = 116,5° — угол между связями H–O–H
- d = 1,28 Å — длина связи между атомом водорода и кислорода
- Большие круги обозначают атомы кислорода (O⁻)
- Маленькие круги — атомы водорода
- Центральный угол и расстояние указывают пространственную структуру молекулы
Уравнение разложения перекиси водорода (H₂O₂), которое происходит с выделением кислорода. В процессе разложения перекись водорода распадается на воду и кислород, при этом выделяется энергия:
2H₂O₂ → 2H₂O + O₂ + 196,1 кДж
Формула показывает, что две молекулы перекиси водорода (H₂O₂) при разложении дают две молекулы воды (H₂O), одну молекулу кислорода (O₂) и выделяют 196,1 кДж энергии. Это экзотермическая реакция, которая используется в различных процессах, включая дезинфекцию и очистку
Хлорсодержащие дезинфектанты: основы и применение
Хлорсодержащие дезинфектанты являются одними из самых распространённых средств для уничтожения микроорганизмов, бактерий и вирусов. Благодаря своим мощным окислительным свойствам, хлор и его производные эффективно используются в самых различных отраслях, где требуется санитарная очистка воды и поверхностей. В частности, они находят широкое применение в очистных сооружениях, плавательных бассейнах и пищевой промышленности

Основное преимущество хлорсодержащих препаратов — их способность быстро уничтожать патогенные микроорганизмы при сравнительно низких дозах, что делает их экономически эффективными. Однако использование этих веществ требует осторожности, так как многие из них токсичны и могут быть опасны при неправильном обращении
В данной категории дезинфектантов выделяются такие химические вещества, как газообразный хлор, диоксид хлора и трихлороизоциануровая кислота. Каждый из этих препаратов имеет свои особенности применения и правила безопасности, которые должны учитываться в процессе эксплуатации
Виды хлорсодержащих дезинфектантов
Молекулярная масса: 70.91. Жёлто-зелёный газ с резким запахом. Температура плавления: –101,03°C, кипения: –34,1°C. В водном растворе хлор взаимодействует с водой, образуя следующие компоненты:
Cl₂ + H₂O ⇌ HClO + H+ + Cl⁻ (HCl)
Газообразный хлор используется для дезинфекции воды в бассейнах, однако он обладает высокой токсичностью и требует осторожного обращения
Молекулярная масса: 86.91. Жёлтый газ, в жидком состоянии — ярко-красный. Температура плавления: –59°C, кипения: 9,7°C
Реагирует с водой, образуя: 2ClO₂ + H₂O → HClO₂ + HClO₃
Диоксид хлора считается более безопасным по сравнению с хлором, но он также обладает взрывоопасными свойствами при температуре 30–50°C. Этот продукт используется как альтернатива хлору в дезинфекции
Это химическое соединение обладает антимикробной активностью и эффективно борется с бактериями, включая возбудителей внутрибольничных инфекций, микобактерии туберкулёза и вирусы, такие как гепатит и ВИЧ. Применяется в виде таблеток для растворения в воде, образуя активное дезинфицирующее вещество
Эти дезинфектанты играют важную роль в поддержании санитарной безопасности на очистных сооружениях, в плавательных бассейнах и других водных системах, требующих строгой микробиологической очистки
Концентрация раствора
Концентрация — это важнейший параметр, характеризующий состав раствора, отражающий количество растворённого вещества по отношению к объёму или массе всего раствора. Иными словами, концентрация показывает, насколько «насыщен» раствор тем или иным компонентом и позволяет количественно оценить степень присутствия вещества в растворённой форме
Значение концентрации необходимо для точного расчёта дозировок в химических, биологических и технологических процессах. От неё напрямую зависят эффективность реакций, санитарная безопасность, свойства среды и соответствие нормативным требованиям. Концентрация может выражаться в различных единицах в зависимости от метода расчёта — процентах, граммах на литр, молях на литр и других
Различные способы выражения концентрации используются в зависимости от задач: для технологического контроля, приготовления рабочих растворов, лабораторного анализа или санитарной обработки. В частности, в области дезинфекции точное знание концентрации позволяет добиться стабильного антимикробного эффекта при соблюдении требований безопасности
Процентная концентрация (%) — отношение массы растворённого вещества к массе всего раствора, выраженное в процентах, или количество граммов растворённого вещества в 100 г раствора
P, % (мас.)В граммах растворённого вещества на 1 л раствора — количество граммов растворённого вещества в 1 литре раствора
C,г/дм₃ или г/л; мг/л или ppm; мкг/лCМолярная концентрация — количество моль растворённого вещества в 1 литре раствора
M, моль/лM, моль/лЭквивалентная (нормальная) концентрация — количество эквивалентных масс растворённого вещества в 1 литре раствора
N, г-экв/лN,г-экв/л
Соотношения концентраций различных растворов представляют собой математические выражения, которые позволяют переводить одну единицу измерения концентрации в другую. Это важно в химии и других областях, где требуется точность при приготовлении растворов с заданными характеристиками
Соотношения концентраций растворов определяется по формуле
Р = С/10ρ = М·Мв/10ρ = N·Э/10ρ
- Mмол — молекулярная масса растворённого вещества
- ρρ — плотность раствора
- EE — эквивалентная масса растворённого вещества в г/см³
Значение «рН» — водородный показатель рН = - lg [H+], где [H+] — концентрация ионов водорода г-ион/л.
В чистой воде [H+] = [OH-] = 10-7 / рН = - lg 10-7 = 7 (нейтральная среда)
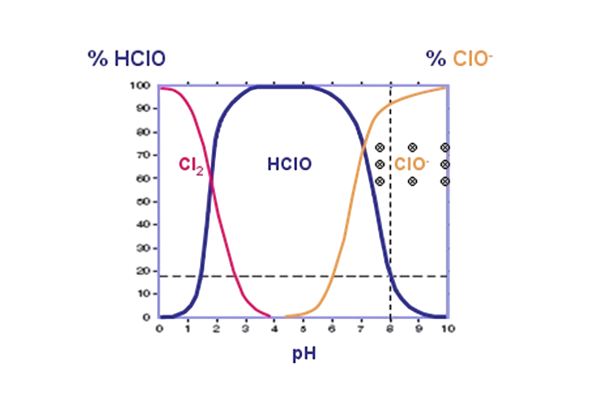
Содержание активных форм хлора в зависимости от уровня рН

Цветовая шкала pH — это наглядный способ определения кислотности или щелочности раствора, основанный на изменении окраски индикаторов в зависимости от концентрации ионов водорода (H⁺) или гидроксид-ионов (OH⁻). Эта шкала широко применяется в химии, биологии, медицине и промышленности для оценки среды, в которой проходят те или иные процессы
- Фиолетовый (pH = 0) — Сильно кислая среда / Высокая концентрация ионов H⁺ (~1 г-экв/л)
- Малиновый (pH = 1) — Сильно кислая [H⁺] = 0.1 г-экв/л.
- Красный (pH = 2–3) — Кислая среда / Значения [H⁺] от 10⁻² до 10⁻³ г-экв/л.
- Оранжевый (pH = 4) — Слабо кислая /Умеренное содержание водородных ионов
- Жёлтый (pH = 5–6) — Слабо кислая / Приближение к нейтральной среде
- Зелёный (pH = 7) — Нейтральная среда [H⁺] = [OH⁻], вода и большинство биологических жидкостей
- Светло-зелёный (pH = 8–9) — Слабо щелочная / Преобладание гидроксид-ионов
- Бирюзовый (pH = 10–11) — Щелочная среда [OH⁻] от 10⁻³ до 10⁻² г-экв/л.
- Синий (pH = 12–13) — Сильно щелочная / Значительное содержание OH⁻
- Тёмно-синий (pH = 14) — Сильно щелочная [OH⁻] = 1 г-экв/л.
| N г-экв/л [H+] | рН | N г-экв/л [OH-] |
| 1 | 0 | 10 *(-14) |
| 0.1 | 1 | 10 *(-13) |
| 10 *(-2) | 2 | 10 *(-12) |
| 10 *(-3) | 3 | 10 *(-11) |
| 10 *(-4) | 4 | 10 *(-10) |
| 10 *(-5) | 5 | 10 *(-9) |
| 10 *(-6) | 6 | 10 *(-8) |
| 10 *(-7) | 7 | 10 *(-7) |
| 10 *(-8) | 8 | 10 *(-6) |
| 10 *(-9) | 9 | 10 *(-5) |
| 10 *(-10) | 10 | 10 *(-4) |
| 10 *(-11) | 11 | 10 *(-3) |
| 10 *(-12) | 12 | 10 *(-2) |
| 10 *(-13) | 13 | 0.1 |
| 10 *(-14) | 14 | 1 |
Буферные растворы
Это растворы, обладающие способностью поддерживать стабильное значение pH при добавлении небольших количеств кислоты или щелочи, а также при незначительных разбавлениях. Такая устойчивость достигается за счёт присутствия в составе буфера сопряжённой кислотно-основной пары, которая реагирует с поступающими ионами водорода (H⁺) или гидроксида (OH⁻), предотвращая резкие изменения кислотности среды
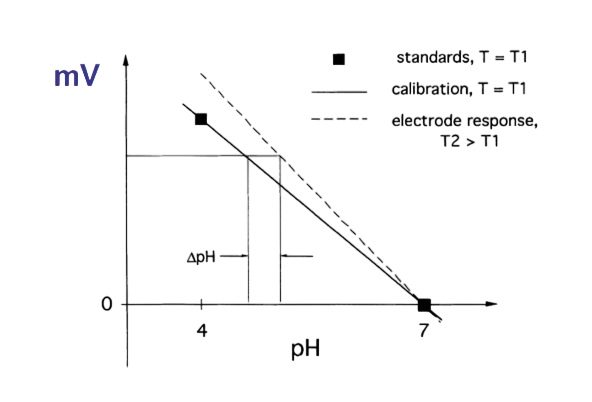
Калибровка электродов
Калибровка pH-электродов проводится с использованием стандартных буферных растворов с известным значением pH (например, pH = 4 и pH = 7). На графике видно, как изменяется отклик электрода (в мВ) в зависимости от уровня pH и температуры (T₁, T₂). При изменении температуры чувствительность электрода может смещаться (пунктирная линия), поэтому важна регулярная калибровка в условиях, близких к рабочим
Калибровка позволяет обеспечить точность измерений и устранить систематические погрешности, вызванные старением электрода или внешними факторами

Система измерения общего активного хлора
Автоматизированная система, предназначенная для анализа содержания общего активного хлора в воде:
- Реагент «А» — буферный раствор с pH = 4,5, обеспечивающий стабильные условия реакции
- Реагент «В» — раствор йодида калия (KI), который вступает в реакцию с активным хлором, позволяя проводить точное фотометрическое измерение его концентрации
Такие системы широко применяются на водоочистных станциях, в бассейнах и пищевой промышленности для постоянного мониторинга качества воды и соответствия санитарным нормам
Окислительно-восстановительный потенциал (ОВП)
Или редокс-потенциал (от англ. RedOx — Reduction/Oxidation) представляет собой величину, отражающую химическую активность элементов и соединений в реакциях, где происходит изменение заряда ионов в растворах
Cl₂ + H₂ = HClO + HCl
HCl + NaOH = NaCl + H₂O
Виды редокс-сред:
- Окислительная среда — значения E(0)298 (или Eh) превышают +100...150 мВ. Это свидетельствует о наличии свободного кислорода и высоком окислительном потенциале воды
- Переходная зона — Eh в диапазоне от 0 до +100 мВ. Характеризуется нестабильными условиями между восстановлением и окислением
- Восстановительная среда — значения Eh отрицательные (Eh < 0). Типична для подземных вод, где присутствуют ионы металлов в низких степенях окисления (Fe²⁺, Mn²⁺, Mo⁴⁺), а также сероводород
ОВП напрямую зависит от температуры и уровня pH раствора. При обработке воды, особенно в бассейнах, редокс-потенциал используется как один из ключевых показателей контроля качества. Он помогает судить об эффективности обеззараживания
Зависимость ОВП от времени жизни E.coli:
| ОВП, мВ | Время жизни E.Coli, мин |
| 450–500 | 167 |
| 500–550 | 6 |
| 550–600 | 1,7 |
| 700–750 | 0,2 |
| 750–800 | 0,05 |
Чем выше значение ОВП, тем быстрее погибают патогенные микроорганизмы, что подтверждает его значение в системах дезинфекции
Вещества содержащие хлор
Содержащие хлор соединения отличаются по степени окисления элемента и, соответственно, по химическим и окислительным свойствам. По мере увеличения степени окисления хлора возрастают как кислотные, так и окислительные свойства соединений
- Хлориды
Представляют собой соли соляной кислоты (HCl)
Пример: NaCl — хлорид натрия (поваренная соль) - Хлор
Элементарный газообразный хлор — Cl₂ — используется в дезинфекции и синтезе хлорсодержащих соединений - Гипохлориты
Соли хлорноватистой кислоты (HClO)
Пример: NaClO — гипохлорит натрия. Применяется в бытовых и промышленно-дезинфицирующих средствах - Хлориты
Производные хлористой кислоты (HClO₂)
Пример: NaClO₂ — хлорит натрия. Является источником диоксида хлора:
5NaClO₂ + 4HCl = 5NaCl + 4ClO₂↑ + 2H₂O
- Хлораты
Соли хлорноватой кислоты (HClO₃)
Примеры: NaClO₃, KClO₃ (бертолетова соль). Обладают сильными окислительными свойствами как в растворах, так и в твёрдом виде. В смеси с органическими веществами (углерод, сера и др.) способны детонировать - Перхлораты
Соли хлорной кислоты (HClO₄)
Пример: NaClO₄ — перхлорат натрия. В свободном состоянии перхлораты крайне взрывоопасны
Гипохлорит натрия (NaClO)
Гипохлорит натрия — бесцветное кристаллическое вещество, обладающее выраженной нестабильностью. Содержит до 95,2% активного хлора — это эквивалент количества хлора (Cl₂), которое высвобождается при реакции с соляной кислотой:
NaClO + 2HCl → Cl₂ + NaCl + H₂O
Cl⁻ — le⁻ → Cl⋅

Физико-химические свойства
- Моногидрат (NaClO·H₂O): быстро разлагается при температуре выше 60°C, при ~70°C может взрываться
- Растворимость NaClO (массовая доля): 20,6% при –10°C / 22,8% при 0°C / 27,5% при 10°C / 45,0% при 25°C / 50,0% при 30°C
- Гигроскопичность: не проявляется, однако на воздухе NaClO быстро переходит в жидкое состояние из-за разложения
В водном растворе гипохлорит натрия склонен к разложению. При комнатной температуре он может терять до 30% активного хлора за 10 дней. Реакция разложения: 2NaClO → 2NaCl + O₂↑
Факторы, влияющие на стабильность
На стабильность гипохлорита натрия влияет ряд факторов. Распад вещества ускоряется при наличии хлоридов щелочных металлов. В то же время разложение замедляют такие добавки, как сульфат магния (MgSO₄), метасиликат натрия (Na₂SiO₃), борная кислота (H₃BO₃), а также гидроксид натрия (NaOH). Последний особенно эффективен, так как повышение pH среды значительно повышает устойчивость раствора
Активный хлор (суммарный)
Активный хлор — это совокупность всех форм хлорсодержащих веществ в растворе, обладающих окислительной способностью. Он подразделяется на две категории: свободный и связанный активный хлор
К этой группе относятся сильные окислители, наиболее эффективные с точки зрения обеззараживания:
- Cl₂ — молекулярный хлор
- HClO — хлорноватистая кислота
- ClO⁻ — гипохлорит-ион
Это более слабые окислители, которые формируются при взаимодействии хлора с аммиаком и органическими аминогруппами. Их также называют хлораминами:
- NH₂Cl — монохлорамин
- NHCl₂ — дихлорамин
- NCl₃ — трихлорид азота
Обычно при анализе воды определяют общее содержание активного хлора как сумму Cl₂, HClO и ClO⁻. Концентрации отдельных компонентов можно вычислить, опираясь на показатели pH и значения равновесных констант
Методы определения остаточного активного хлора по ГОСТ 18190-72
Остаточный активный хлор (ОАХ) включает как свободные, так и связанные формы активного хлора. Для их количественного анализа используются различные методики, каждая из которых имеет свою специфику
| Метод | Применение |
| Иодометрический метод | Применяется для одновременного определения общего количества свободного и связанного активного хлора. Анализ проводится при подкислении пробы до pH 4,5. Метод рекомендуется использовать при концентрации активного хлора свыше 0,3 мг/л. Основные реакции: HClO + HCl + 2KI → J₂ + 2KCl + H₂ / NHCl₂ + 3HCl + 4KI → 2J₂ + NH4Cl + 4KC / J₂ + 2Na₂S₂O₃ →2NaJ + NaS₂S4O6 |
| Метод с метиловым оранжевым | Предназначен для определения только свободного остаточного активного хлора. Основан на том, что свободный хлор способен окислять метиловый оранжевый, в то время как хлорамины (связанный хлор) — нет, из-за более слабого окислительного потенциала |
| Расчёт связанного активного хлора | Количество связанного активного хлора определяют как разность между результатами методов 1 и 2. Также может использоваться методика Пейлина |
Эти методы позволяют раздельно контролировать содержание различных форм хлора, что особенно важно при анализе воды в системах дезинфекции и водоподготовки
Образование связанного хлора
Мочевина и её взаимодействие с активным хлором
Мочевина (карбамид) — это диамид угольной кислоты с формулой (NH₂)₂CO. Человеческий организм выделяет от 25 до 30 граммов мочевины в сутки (при объёме мочи около 1–1,5 литра). Объём мочевого пузыря в среднем составляет от 250 до 500 мл. Концентрация мочевины составляет 20–25 г/л.
- Реакция с хлоритом натрия (NaClO):
(NH₂)₂CO + NaClO + 2 NaOH = N₂H₂ + NaCl + Na₂CO₃ + H₂O 3.6 г AX - Образование аммиака (NH₃):
N₂H₂ + H₂O = N₂H₅OH 4.7 г AX - Продолжение реакции с хлором:
N₂H₅OH + NaClO = N₂ + 2 NaCl + 3 H₂O - Реакции с гидроксидом аммония (NH₄OH):
NH₄OH + NaClO = NH₂Cl + NaOH + H₂O - Дальнейшая реакция с NaClO:
+ NaClO = NHCl₂ + NaOH
+ NaClO = NCl₃ + NaOH 14.3 г AX
Дезинфектанты и их свойства

Ультрафиолетовая обработка
Ультрафиолетовая (УФ) дезинфекция — это один из распространённых методов физического обеззараживания воды. Она эффективна при обработке предварительно очищенной воды и наилучшим образом подходит для замкнутых систем
Применяется в следующих областях:
- очистка сточных вод
- дезинфекция питьевой воды
- водоподготовка для фармацевтического и микроэлектронного производства

Фторирование воды (F⁻)
Фторирование — важный элемент системы питьевого водоснабжения, направленный на профилактику заболеваний, связанных с дефицитом фтора
Контроль за содержанием фторид-ионов (F⁻) в воде осуществляется с помощью специализированных датчиков и приборов, обеспечивающих точное дозирование и стабильность процесса фторирования
Фторирование воды
В водоснабжении начали использовать другие формы фтора. Вместо солей фтора начали применять более дешёвые кремнефториды, такие как гексафторкремниевая кислота (H₂SiF₆), отходы производства минеральных удобрений при обработке фосфатов серной кислотой
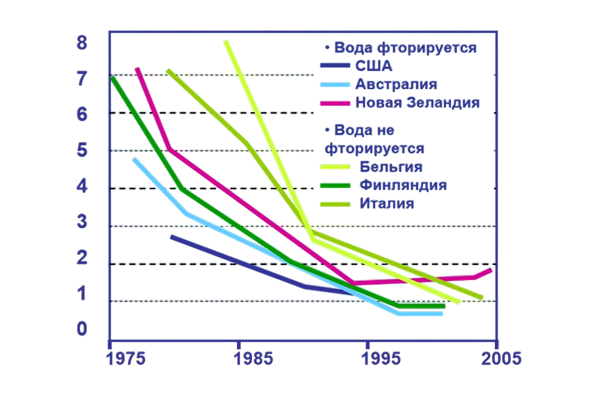
Показатель распространённости кариеса
График ниже показывает, как изменяется уровень распространённости кариеса в разных странах в зависимости от фторирования воды:
- США, Австралия, Новая Зеландия — использование фторированной воды значительно снижает распространённость кариеса
- Бельгия, Финляндия, Италия — страны, где вода не фторируется, показывают более высокий уровень кариеса
Фторирование воды стало важным шагом в профилактике кариеса, способствуя снижению его распространённости по мере повышения концентрации фтора в питьевой воде
Вещества, используемые при проведении процесса дезинфекции
Процесс дезинфекции включает в себя использование различных химических веществ, которые обеспечивают эффективное уничтожение микроорганизмов и бактерий в воде и других средах
Молекулярная масса (Mₐ) = 17
Аммиачная вода — раствор аммиака (NH₃) в воде. Содержит от 20 до 35% аммиака. Эти растворы обладают резким запахом и относятся к горячим жидкостям. Аммиак часто используется для продления действия хлора при хлорировании воды
Реакция с хлором: NH4OH + NaClO = NH₂Cl + NaOH + H₂O
Кроме того, аммиак подщелачивает воду, что способствует улучшению химической реакции
Молекулярная масса (Mₐ) = 40
Натриевая щёлочь поставляется в виде гранул или пластинок, хорошо растворяется в воде с выделением тепла. Это щелочной реагент, который повышает pH раствора. Её используют для регулировки кислотности в процессе водоочистки и дезинфекции
Молекулярная масса (Mₐ) = 106
Растворимость в воде — 210 г/л. Сода используется для нейтрализации кислот, а также для подщелачивания воды.
Реакция с хлорной кислотой:
Реакция с хлором: Na₂CO₃ + 2HCl = 2NaCl + CO₂↑ + H₂O
Молекулярная масса (Mₐ) = 36,5
Соляная кислота — бесцветная жидкость с резким запахом, которая является сильной одноосновной кислотой. При растворении в воде выделяется значительное количество тепла.
Используется для понижения pH в процессах очистки и водоподготовки. В реакциях с щелочами, такими как NaOH, образуются соли и вода:
Реакция с хлором: NaOH + HCl = NaCl + H₂O
Эти вещества играют ключевую роль в процессе дезинфекции и водоочистки, обеспечивая контроль кислотности, активность хлора и другие параметры для поддержания санитарных стандартов
Современные средства для обработки воды в бассейнах

Во время эксплуатации бассейна в воду попадают различные микроорганизмы, такие как бактерии, вирусы и грибки, а также образуются отложения на стенках в виде слизи или тёмного налёта. Чтобы избежать этого, необходимо регулярно или постоянно дозировать в воду дезинфицирующие средства и использовать регуляторы pH
Состав: гипохлорит натрия, натр едкий, вода.Содержание активного хлора: не менее 80 г/дм³. Эти средства эффективно борются с загрязнением воды, уничтожая микроорганизмы
Состав: водный раствор неорганической кислоты с антикоррозийными добавками. Применяется для снижения уровня pH воды, что предотвращает повышение её щелочности и помогает поддерживать оптимальные условия для дезинфекции
Состав: водный раствор неорганической щёлочи и активные добавки. Используется для повышения уровня pH, улучшая условия для эффективной работы дезинфицирующих средств и стабилизации воды
Состав: водный раствор сернокислого алюминия (Al₂(SO₄)₃). Применяется для удаления взвешенных частиц и улучшения прозрачности воды, с помощью связывания загрязнений в более крупные агрегаты, которые затем можно удалить
| Дезинфектант | ОВП Е° В |
Органо-лептические свойства | Образование побочных веществ | Технические сложности | Прочее |
| Озон | 2.07 | Нет привкуса | Кислород | Высокая стоимость оборуд. | Ядовит |
| Перекись водорода | 1.77 | Нет привкуса | Вода или кислород | Высокая стоимость реагента | — |
| Перманганат калия | 1.67 | Привкус | MnO₂ ; Mn²+ | Высокая стоимость реагента | Осадок MnO₂ |
| Диоксид хлора | 1.57 | Привкус | Хлориды Cl-, хлорамины и др. | Высокая стоимость реагента | Ядовит |
| Хлорноватистая кислота | 1.49 | Привкус | Хлориды Cl-, хлорамины и др. | — | — |
| Хлор | 1.36 | Привкус | Хлориды Cl-, хлорамины и др. | Спец. оборудование | Коррозия оборудования. Ядовит |
| Кислород | 1.23 | Нет привкуса | Нет | Опасность пожара | — |
| Бром | 1.09 | Привкус | Бромиды | Высокая стоимость реагента | — |
| Йод | 0.54 | Привкус | Иодаты | Высокая стоимость реагента | — |
Классификация электролитов по степени диссоциации
Сила кислот и оснований определяется тем, насколько полно их молекулы распадаются (диссоциируют) на ионы в водном растворе
Растворы сильных кислот и щелочей полностью диссоциируют, образуя высокую концентрацию ионов водорода (H⁺) или гидроксид-ионов (OH⁻). В противоположность им, растворы слабых кислот и оснований содержат значительно меньше ионов, так как диссоциация происходит лишь частично
| Сильные | Слабые |
| Кислоты | Кислоты |
| HClO₄ — хлорная кислота | H₂SiO₃ — кремниевая кислота |
| HNO₃ — азотная кислота | H₃BO₃ — борная кислота |
| HCl — соляная кислота | H₂CO₃ — угольная кислота |
| H₂SO₄ — серная кислота | Большинство органических кислот (например, уксусная, лимонная и др.) |
| Щёлочи | Щёлочи |
| NaOH — гидроксид натрия | NH₄OH — гидроксид аммония |
| KOH — гидроксид калия | Al(OH)₃ — гидроксид алюминия |
| Ca(OH)₂ — гидроксид кальция | Fe(OH)₃ — гидроксид железа (III). Все органические основания (например, амины) |
Гидролиз
Гидролиз — это реакция взаимодействия ионов соли с ионами воды (H⁺ и OH⁻), в результате которой раствор приобретает кислую или щелочную реакцию
Пример гидролиза сульфата алюминия:
- Al₂(SO₄)₃ + 2OH⁻ → 2(AlOH)SO₄ + H₂SO₄
- 2(AlOH)SO₄ + 2H₂O → [Al(OH)₂]₂SO₄ + H₂SO₄
- [Al(OH)₂]₂SO₄ + 2H₂O → 2Al(OH)₃↓ + H₂SO₄
Суть процесса
Гидролиз противоположен нейтрализации. Он зависит от природы кислоты и основания, из которых образована соль:
- Соль сильной кислоты и слабого основания
При гидролизе в растворе преобладает ион H⁺, так как кислота полностью диссоциирует, а основание — нет. Реакция среды: кислая (pH < 7) - Соль слабой кислоты и сильного основания
В растворе преобладает ион OH⁻, поскольку основание диссоциирует полностью, а кислота — частично. Реакция среды: щелочная (pH > 7)
| Дисперсная фаза | Дисперсионная среда | Наименование | Примеры |
| Жидкость | Газ | Ж. аэрозоли | Туман |
| Твердое тело | Газ | Тв. аэрозоли | Дым, пыль |
| Газ | Жидкость | Пены | Мыльные пены |
| Жидкость | Жидкость | Эмульсии | Молоко |
| Твердое тело | Жидкость | Золи | Жидкая глина, глина |
| Газ | Твердое тело | Тв. пены | Пенополистирол |
| Жидкость | Твердое тело | Тв. эмульсии | Опал, жемчуг |
| Твердое тело | Твердое тело | Тв. суспензии | Окрашенные пластмассы |
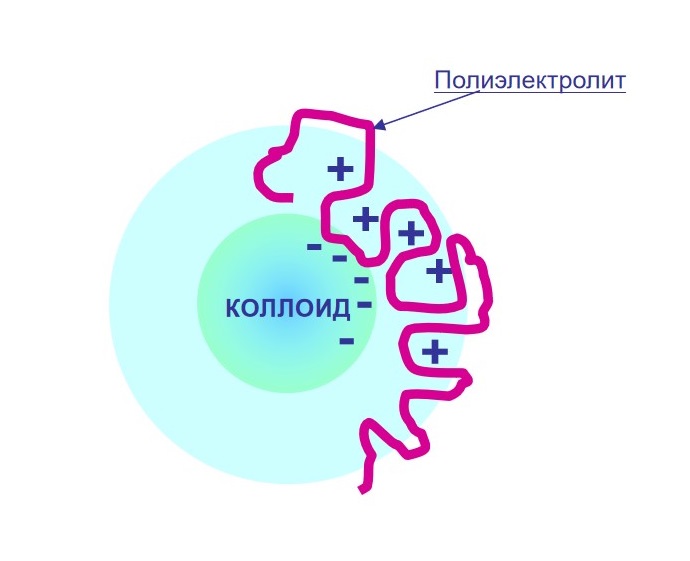
Коагуляция
Коагуляция — это процесс слипания частиц коллоидной системы, возникающий при их столкновениях. Эти столкновения могут происходить в результате теплового (броуновского) движения, механического перемешивания или направленного воздействия внешнего силового поля
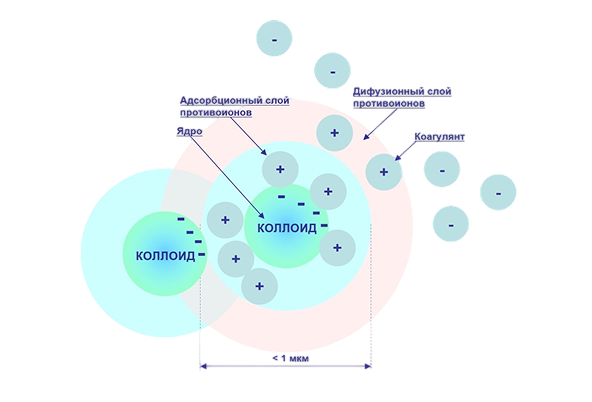
- Ядро окружено положительно или отрицательно заряженными ионами
- Вокруг ядра формируется адсорбционный слой противоионов, далее — диффузионный слой, где ионы распределены менее упорядоченно
- Введение коагулянтов нарушает баланс зарядов, снижает стабильность коллоидной системы и способствует слипанию частиц
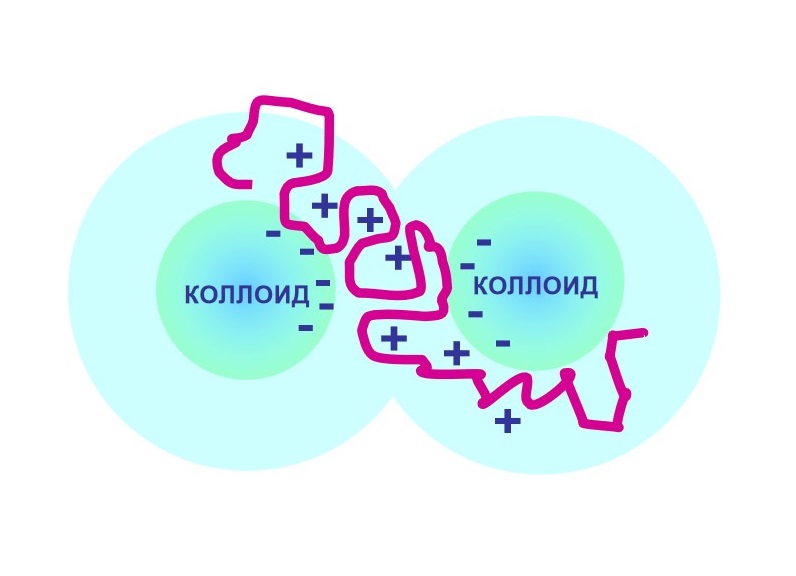
Флокуляция
Флокуляция — это разновидность коагуляции, при которой мелкие частицы, находящиеся в взвешенном состоянии в жидкости или газе, объединяются в рыхлые агрегаты — флокулы, напоминающие хлопья
Этот процесс происходит благодаря действию флокулянтов, таких как полиэлектролиты, которые связывают коллоидные частицы за счёт электростатических взаимодействий
Этапы флокуляция:
- Начало адсорбции — полиэлектролит взаимодействует с отдельной частицей
- Начало флокуляции — полиэлектролит соединяет несколько частиц, образуя рыхлое хлопьевидное скопление
Флокуляция широко применяется в водоочистке, химии и пищевой промышленности для удаления мелкодисперсных загрязнений
Системы дозирования и дезинфекции
Системы дозирования и дезинфекции играют ключевую роль в промышленности, обеспечивая точность и безопасность процессов, связанных с добавлением химических реагентов в жидкие среды. Такие насосы-дозаторы используются в различных отраслях, включая водоснабжение, химическую и пищевую промышленность, а также в коммунальном хозяйстве для очистки и дезинфекции воды
Основная цель этих систем — гарантировать надежное и эффективное внесение определенных химических веществ в нужных количествах, что обеспечивает требуемый уровень качества и безопасности продукции или воды. рассмотрим основные популярные модели от Grundfos

SELCOPERM
- для электролитического получения раствора гипохлорита натрия
- получение надежного дезинфектанта на месте эксплуатации
- исходные продукты: поваренная соль и питьевая вода
- успешные инсталляции на водоканалах крупных городов
- производительность установок: от 125 г/ч до 50 кг/ч по активному хлору (и более)
- соответствие всем требованиям промышленной безопасности и санитарным нормам СанПин 2.1.4.10.74-01

SELCOPERM 125-2000
- производительность: 110–1800 г/ч.
- расход воды: 140–170 л/кг активного хлора
- расход соли: прибл. 4–4,5 кг NaCl/кг активного хлора
- концентрация гипохлорита натрия: 0,5–0,65 %
- потребляемая мощность (перем. ток): прибл. 5,5–6,5 кВт•ч/кг активного хлора

SELCOPERM 5000-45000
- Высокий уровень автоматизации технологического процесса — минимизация участия оператора
- Нетоксичное и доступное сырьё: используется только поваренная соль, вода и электроэнергия
- Максимальная промышленная безопасность — не требуется дополнительных мер по взрывозащите на месте установки
- Полная независимость от внешних поставок реагентов — производство дезинфектанта осуществляется на месте
- Отсутствие затрат на логистику: не требуется транспортировка, хранение и использование жидкого хлора или товарного гипохлорита

VACCUPERM
- вакуумные установки для дозирования газа (хлора, аммиака, углекислого газа, диоксида серы)
- вся установка дозирования газа находится в разряженном состоянии, поддерживая вакуум
- вакуум в системе обеспечивает высокую степень надежности и безопасности
- процесс дозирования газа охватывает весь путь — от контейнера с хлором до точки инжекции

POLYDOS
- Автоматические установки для приготовления рабочих растворов химических реагентов
- Диапазон концентраций растворов: от 0,05% до 0,5%
- Подходят для работы как с сухими, так и с жидкими концентратами
- Совместимы с широким спектром веществ, включая: органические полимеры, флокулянты, коагулянты (например, сульфат алюминия), карбонат натрия (сода), известковое молочко, бентонит, сульфат аммония, активированный уголь и другие химические реагенты, применяемые в водоочистке и промышленных процессах

OXIPERM PRO
- производство раствора диоксида хлора при концентрации 2 г/л из 7,5% раствора хлористого натрия (NaClO₂) и 9% соляной кислоты (HCl)
- производительность установки: от 5 до 60 г/час
- инновационная технология получения диоксида хлора — минимальный расход химикатов
- снижение затрат на реагенты до 40% по сравнению с традиционными системами
- встроенный контроллер с возможностью подключения измерительной ячейки — поддержание стабильной концентрации дезинфектанта в сети
- надёжная дезинфекция: уничтожение и предотвращение образования биоплёнок (включая легионеллы и другие патогены)
Вывод
Эффективная дезинфекция воды — это комплексный процесс, включающий не только уничтожение патогенных микроорганизмов, но и стабилизацию физико-химических параметров среды. Для достижения санитарных норм применяются различные методы: от химических (гипохлорит, перекись водорода, озон) до физических (ультрафиолет, фторирование). Каждый из них требует точного расчёта концентраций, понимания кислотно-щелочного баланса (pH), а также учёта процессов, таких как гидролиз и буферное действие
Особое внимание уделяется взаимодействию активного хлора с органическими и неорганическими загрязнителями, в том числе мочевиной, что важно при эксплуатации бассейнов. Расчёт остаточного хлора, учёт его свободных и связанных форм, а также определение ОВП (окислительно-восстановительного потенциала) позволяют объективно контролировать степень обеззараживания воды
Дополнительную роль играют процессы коагуляции и флокуляции, направленные на удаление коллоидных и взвешенных частиц. Они обеспечивают не только микробиологическую, но и визуальную чистоту воды, устраняя помутнение и осадок
Таким образом, обеспечение качества воды — это строго выверенное взаимодействие химии, физики и инженерии, в основе которого лежат знания о диссоциации, реакциях нейтрализации, гидролизе, электролитах и агрегатных превращениях частиц